![<strong>리뉴얼된 반려견인지기능장애 신약 제다큐어 츄어블정</strong><br>
[지엔티파마 제공. 재판매 및 DB 금지]](http://www.hmj2k.com/data/photos/20250207/art_17394181363491_0a4a25.jpg)
신약 개발 벤처기업 지엔티파마는 반려견 인지기능장애 신약 '제다큐어'가 시판 후 조사에서 장기복용 약효와 안전성이 확인됐다고 14일 밝혔다.
제다큐어는 세계 최초로 개발된 이중표적 뇌세포 보호 신약으로, 사람의 알츠하이머병과 유사한 인지기능장애를 앓고 있는 반려견 치료약물로 2021년 2월 국내 첫 합성신약 동물용의약품으로 승인받았다.
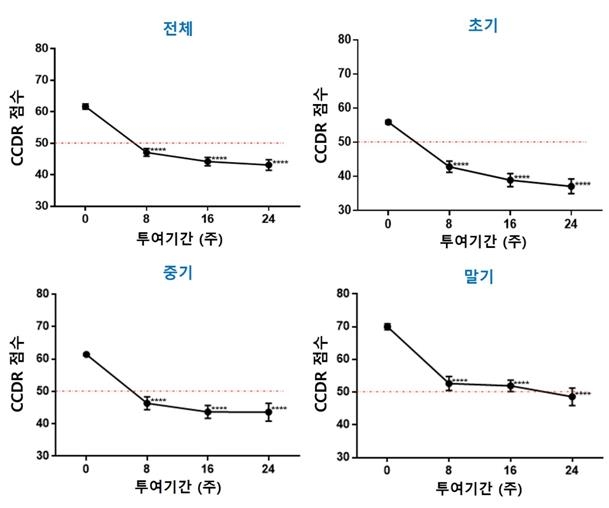
지엔티파마 측은 "시판 후 최근 3년간 40여개 동물병원에서 진행된 조사를 통해 제다큐어의 장기 복용 약효와 새로운 적응증이 밝혀지고 있다"며 "인지기능장애를 앓고 있는 초기, 중기, 말기 반려견에 제다큐어를 6개월 이상 투여해도 특별한 부작용이 없었으며, 장애 개선 효과가 확연하게 나타났다"고 설명했다.
광주 송정동물의료센터 고진 원장은 "인지기능장애를 앓고 있는 반려견에 제다큐어를 6개월 이상 장기간 투여 시 안전성과 증상 개선이 확인됐다"며 "특히 밤에 더 잠을 잘 자고, 대소변 실수가 감소했다"고 전했다.
이에 따라 지엔티파마는 제다큐어의 국내 유통망 확대는 물론 해외시장 진출을 추진하고 있다.
특히 일본, 대만, 이탈리아 시장에 연내 출시를 위해 현지 제약사와 협의를 진행하고 있으며, 글로벌 상위 10위 내 4개 동물용의약품 회사와 연내 특허사용 계약을 목표로 협의 중이라고 했다.
곽병주 지엔티파마 대표이사는 "시판 후 조사를 통해 제다큐어를 장기 복용하는 인지기능장애 반려견들의 인지기능과 일상생활이 거의 정상으로 회복되는 사실을 확인했다"며 "미국식품의약국(FDA)과 유럽의약품청(EMA)에서 이를 인정해주고 있기 때문에 제다큐어의 글로벌 시장진출에 청신호로 받아들이고 있다"고 말했다.




